En diversos estudios europeos se ha comprobado que la proporción de casos secundarios en convivientes cercanos a un caso índice de enfermedad meningocócica invasiva oscila entre el 3-16%. Los estudios observacionales han demostrado que la quimioprofilaxis de convivientes puede erradicar N. meningitidis de la nasofaringe y reducir los casos de enfermedad meningocócica invasiva entre convivientes. Existen menos datos sobre los indices de transmisión asintomática de N. meningitidis entre convivientes de un caso índice. El Centro Europeo para Prevención y Control de Enfermedades ha desarrollado una guía de manejo de los contactos de pacientes con enfermedad meningocócica invasiva. En W. Hellenbrand, G. Hanquet, S. Heuberger, S. Nielsen, P. Stefanoff, and J. M. Stuart. What is the evidence for giving chemoprophylaxis to children or students attending the same preschool, school or college as a case of meningococcal disease? Epidemiol.Infect.:1-11, 2011; se recogen las evidencias existentes sobre la utilidad de la quimioprofilaxis frente a N. meningitidis. Este estudio no identifica la existencia de evidencias directas de la efectividad de la quimioprofilaxis en contactos de enfermedad meningocócica invasiva. Este estudio muestra que los contactos escolares y preescolares de un caso indice en los que la quimioprofilaxis no fue recomendada muestran un incremento significativo del riesgo de enfermedad meningocócica invasiva, aunque este riesgo es considerablemente menor que para los contactos familiares.
A través de otros estudios se ha comprobado que los contactos domésticos de un caso índice de enfermedad invasiva tienen un riesgo aumentado de desarrollar infección sistémica y que este riesgo se mantiene elevado durante la primera semana postexposición, para disminuir luego rápidamente. La quimioprofilaxis antibiótica se ha mostrado eficaz en el control del riesgo de infección sistémica tras contacto con un caso de enfermedad diseminada, riesgo que va a depender de las características de la cepa, del ambiente y del huésped. Las recomendaciones actuales sobre control de la enfermedad meningocócica pueden consultarse en: National Electronic Telecommunications System for Surveillance CDC. Prevention and Control of Meningococcal Disease: Recommendations of the Advisory Committee on Immunization Practices (ACIP) . 2000. El antibiótico habitualmente utilizado en quimioprofilaxis frente a N. meningitidis es la rifampicina a dosis de 10 mg/Kg, dos dosis al día durante 2 días; sin embargo en gestantes o pacientes con enfermedad hepática la ceftriaxona puede ser de elección, dosis IM única de 250 mg o 125 mg en menores de 2 años. El ciprofloxacino es también recomendado por algunos autores, aunque sus indicaciones en pediatría son limitadas. Tras profilaxis la recolonización por N. meningitidis puede ocurrir.
A. Fraser, A. Gafter-Gvili, M. Paul, and L. Leibovici. Prophylactic use of antibiotics for prevention of meningococcal infections: systematic review and meta-analysis of randomised trials. Eur J Clin Microbiol.Infect.Dis. 24 (3):172-181, 2005, evalúan la efectividad del tratamiento quimioprofiláctico antibiótico en la erradicación de N. meningitidis de la nasofaringe. Penicilina, ciprofloxacino, rifampicina y minociclina son efectivos para erradicar N. meningitidis de nasofaringe hasta 1 semana después de recibir profilaxis; sin embargo, tras un periodo de 1-2 semanas, solo rifampicina y ciprofloxacino se mostraron efectivos para erradicar N. meningitidis de nasofaringe. Tras 4 semanas sólo la rifampicina se mostró eficaz. Ningún estudio comparó ceftriaxona con placebo; sin embargo en las comparaciones entre rifampicina y ceftriaxona o ceftriaxona y ciprofloxacino, la ceftriaxona se mostró mas efectiva tras 1-2 semanas para erradicar N. meningitidis de la nasofaringe.
Neisseria meningitidis es un diplococo Gram negativo que forma parte de la flora comensal de la nasofaringe de humanos, pero que igualmente puede originar infeccones sistémicas graves. Es una bacteria que puede ser tanto capsulada como no capsulada que contiene 2.1-2.2 millones de bases en su genoma en aproximadamente 2000 genes. Neisseria meningitidis pertenece a la familia de las Neisseria, integrada por 13 serogrupos en base a la estructura polisacárida de la cápsula, aunque tan solo 6 serogrupos originan enfermedad de forma mas o menos constante en humanos (A, B, C, W-135, X, Y). Diversos autores han comprobado que la transferencia horizontal de genes entre diferentes especies de bacterias puede ser fundamental en la virulencia de N. meningitidis. La mayoría de los componentes de la membrana de la bacteria están ligados a su virulencia (polisacáridos relacionados con la cápsula y el serogrupo, proteínas de la membrana relacionadas con el serotipo, lipooligosacáridos relacionadas con el inmunotipo).
 Neisseria meningitidis continua siendo una de las causas mas frecuentes de sepsis fulminante y meningitis en niños entre los 2 y los 18 años. N. meningitidis puede detectarse en la nasofaringe de individuos no enfermos en hasta el 25 % de la población. Su transmisión se realiza por las secreciones respiratorias.
Neisseria meningitidis continua siendo una de las causas mas frecuentes de sepsis fulminante y meningitis en niños entre los 2 y los 18 años. N. meningitidis puede detectarse en la nasofaringe de individuos no enfermos en hasta el 25 % de la población. Su transmisión se realiza por las secreciones respiratorias.
La emergencia de epidemias de N. meningitidis en determinadas partes del mundo se relaciona con la posibilidad de modificar o expresar los serogrupos de la cápsula de la bacteria. La cápsula de la bacteria esta implicada en la colonización de la bacteria, protegen a la bacteria de la desecación, opsonización, fagocitosis y lisis mediad por complemento. Los anticuerpos dirigidos contra la cápsula están implicados en la inmunidad frente a la enfermedad meningocócica y son la estrategia utilizada que persiguen las vacunas conjugadas antimeningocócicas.
La expresión de la cápsula de la bacteria puede variar in vivo, así determinadas cepas de N. meningitidis definidas como no grupables, pueden recuperar la expresión de la cápsula en contacto con el huésped. Los pili de la bacteria y las proteínas de la membrana del meningococo son esenciales en la adherencia de la bacteria a las superficies epiteliales; en la expresión de estas proteínas se ha comprobado que la presencia de hierro tiene un papel fundamental. Determinados factores relacionados con el equilibrio de óxido reducción y estrés oxidativo del huésped pueden influir en la mayor o menor colonización de N. meningitidis en epitelios. Este aspecto tuve ocasión de comprobarlo en J. Uberos, A. Molina-Carballo, G. Galdo-Munoz, and A. Munoz-Hoyos. Total antioxidant capacity of plasma in asymptomatic carrier state of Neisseria meningitidis. Epidemiol.Infect.:1-4, 2006; al estudiar el riesgo de portador de N. meningitidis ligado al estrés oxidativo de portadores sanos de N. meningitidis.
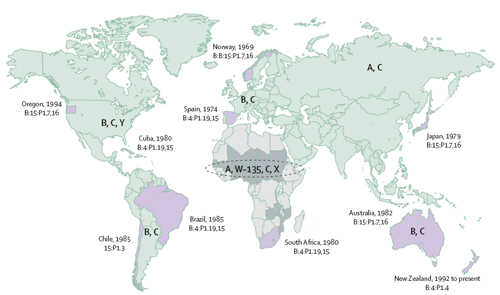
La enfermedad meningocócica puede variar su incidencia desde pocos casos a mas de 1000 por cada 100.000 habitantes-año. El serogrupo A se relaciona con la mayoría de los brotes epidémicos, sobre todo en los países subsaharianos. A partir de la segunda guerra mundial el serogrupo A se hace frecuente en los países industrializados donde origina periódicamente brotes de enfermedad. El serogrupo B se asocia a menos brotes de enfermedad, aunque persiste en situación de endemia en la mayoría de los países indistrializados. El serogrupo C se ha relacionado con brotes locales de enfermedad con mayor proporción de enfermedad invasiva en adolescentes y adultos jóvenes. La figura reproducida de la publicación original D. S. Stephens, B. Greenwood, and P. Brandtzaeg. Epidemic meningitis, meningococcaemia, and Neisseria meningitidis. Lancet 369 (9580):2196-2210, 2007.
 La adquisición del meningococo se realiza a través del contacto estrecho con secreciones de vías respiratorias de un portador, el tamaño del inóculo para que se realice una transmisión efectiva se desconoce. N. meningitidis se adhiere a la superficie epitelial de la nasofaringe donde puede ser fagocitado por células del sistema epitelial fagocítico, permanecer como comensal o invadir la barrera epitelial y originar enfermedad meningocócica. El estado de portador confiere inmunidad frente a N. meningitidis, cuando ocurre enfermedad meningocócica esta se origina 10-14 días después de su adquisición. N. meningitidis coloniza entre 8-25% de los sujetos sanos, la duración del estado de portador varia entre varios días a varios meses y depende de factores propios del huésped, entre los que cabría señalar el estrés oxidativo del huésped, edad, tratamientos antibióticos, tabaquismo y vacunaciones. Algunos meningococos como el serogrupo C (ST-11) son altamente transmisibles, pero raramente originan estado de portador de larga duración. Durante los brotes epidémicos el estado de portador de la población puede ser superior al 10%. La lesión de la mucosa nasofaríngea después de infecciones de tipo vírico puede favorecer tanto la permanencia del estado de portador meningocócico como la enfermedad sistémica. La ausencia de anticuerpos bactericidas es uno de los factores mas importantes para el desarrollo de enfermedad sistémica, que también se ha relacionado con la ausencia de factores de la vía común de activación del complemento (C5-C9). Los lipooligosacáridos son moléculas que activan células del sistema inmune, su presencia como la de todas las endotoxinas supone el fraccionamiento de la bacteria. El receptor de los lipooligosacáridos sobre las células del sistema inmune son tres tipos de moléculas: CD-14, TLR-4 y proteínas de diferenciación mieloide 2 (MD-2). Como resultado de las altas concentraciones de endotoxinas en plasma se produce la excesiva activación del sistema de coagulación y fibrinolisis, resultando en un proceso de coagulación intravascular diseminado. En los pacientes con septiciemia meningocócica fulminante las concentraciones de anticoagulantes naturales, incluyendo antitrombina y proteina C son bajos. La antitrombina inactiva algunos pasos de la cascada de coagulación; por su parte la proteína C inactiva los factores Va y VIIIa. La fibrinolisis se activa por la liberación del factor tisular de activación del plasminógeno, proceso que es inhibido por el factor inhibidor del plasminógeno, ambos productos se liberan en cantidades aumentadas en pacientes con sepsis meningocócica. El sistema kalicreina-kinina también esta activado, dando lugar a la producción de bradicinina que contribuye a la producción de óxido nítrico y la vasodilatación capilar, origen de la hipotensión del shock meningocócico.
La adquisición del meningococo se realiza a través del contacto estrecho con secreciones de vías respiratorias de un portador, el tamaño del inóculo para que se realice una transmisión efectiva se desconoce. N. meningitidis se adhiere a la superficie epitelial de la nasofaringe donde puede ser fagocitado por células del sistema epitelial fagocítico, permanecer como comensal o invadir la barrera epitelial y originar enfermedad meningocócica. El estado de portador confiere inmunidad frente a N. meningitidis, cuando ocurre enfermedad meningocócica esta se origina 10-14 días después de su adquisición. N. meningitidis coloniza entre 8-25% de los sujetos sanos, la duración del estado de portador varia entre varios días a varios meses y depende de factores propios del huésped, entre los que cabría señalar el estrés oxidativo del huésped, edad, tratamientos antibióticos, tabaquismo y vacunaciones. Algunos meningococos como el serogrupo C (ST-11) son altamente transmisibles, pero raramente originan estado de portador de larga duración. Durante los brotes epidémicos el estado de portador de la población puede ser superior al 10%. La lesión de la mucosa nasofaríngea después de infecciones de tipo vírico puede favorecer tanto la permanencia del estado de portador meningocócico como la enfermedad sistémica. La ausencia de anticuerpos bactericidas es uno de los factores mas importantes para el desarrollo de enfermedad sistémica, que también se ha relacionado con la ausencia de factores de la vía común de activación del complemento (C5-C9). Los lipooligosacáridos son moléculas que activan células del sistema inmune, su presencia como la de todas las endotoxinas supone el fraccionamiento de la bacteria. El receptor de los lipooligosacáridos sobre las células del sistema inmune son tres tipos de moléculas: CD-14, TLR-4 y proteínas de diferenciación mieloide 2 (MD-2). Como resultado de las altas concentraciones de endotoxinas en plasma se produce la excesiva activación del sistema de coagulación y fibrinolisis, resultando en un proceso de coagulación intravascular diseminado. En los pacientes con septiciemia meningocócica fulminante las concentraciones de anticoagulantes naturales, incluyendo antitrombina y proteina C son bajos. La antitrombina inactiva algunos pasos de la cascada de coagulación; por su parte la proteína C inactiva los factores Va y VIIIa. La fibrinolisis se activa por la liberación del factor tisular de activación del plasminógeno, proceso que es inhibido por el factor inhibidor del plasminógeno, ambos productos se liberan en cantidades aumentadas en pacientes con sepsis meningocócica. El sistema kalicreina-kinina también esta activado, dando lugar a la producción de bradicinina que contribuye a la producción de óxido nítrico y la vasodilatación capilar, origen de la hipotensión del shock meningocócico.
La presentación clínica de la infección meningocócica incluye la presencia de fiebre y dolor muscular con cefalea y vómitos. En el 25% de los casos se puede observar desde el comienzo un rash maculopapular no petequial que puede ser confundido con un exantema viral, pero que evoluciona rápidamente a un exantema petequial purpúrico. En algunos casos la manifestación inicial es de meningitis, en otros se instaura de forma rápida una sepsis fulminante con choque. Al existir bacteriemia durante esta primera fase se activan tanto el sistema de complemento, como la respuesta inflamatoria, el sistema de coagulación y la fibrinolisis; la activación simultánea de estos elementos conduce al desarrollo de un fallo multiorgánico. A pesar del tratamiento antibiótico, la mortalidad del shock séptico oscila entre el 4 y el 40%. Aunque la mortalidad es alta, no lo es menos la morbilidad, se considera que en hasta un 20% de los casos pueden persistir secuelas.
El diagnóstico definitivo de enfermedad meningocócica se establece por cultivo se sangre, LCR u otros tejidos o exudados en los casos de afección focal. La reacción en cadena de la polimerasa (PCR) puede ser utilizada en algunos laboratorios para detectar la infección. Puede existir leucopenia en el 21% de los pacientes y trombopenia en el 15% con aumento de los reactantes de fase aguda.
Se ha comprobado que determinados individuos tienen mayor dificultad pata limitar la diseminación de la infección y en consecuencia presentan con mas facilidad enfermedad meningocócica. Así, determinadas inmunodeficiencias, defectos de los factores de complemento C3 y C5-C9, asplenia, deficiencia de lectina con afinidad a manosa. Otros factores de riesgo incluyen bajo nivel socieconómico, aglomeraciones humanas y tabaquismo activo o pasivo.
En J. L. Woodard and D. M. Berman. Prevention of meningococcal disease. Fetal Pediatr Pathol. 25 (6):311-319, 2006; se revisa la prevención de la enfermedad meningocócica con las vacunas disponibles en la actualidad.
La primera vacuna disponible frente a meningococo consistió en una vacuna tetravalente frente a los polisacáridos de la cápsula A, C, Y W135. El serogrupo B no se incluyó en la vacuna por ser poco inmunógeno. Entre las limitaciones de esta vacuna se citan la ausencia de respuestas duraderas, la ausencia de respuesta inmunitaria dependiente de células T y la ausencia de inmunogenicidad en niños de menos de 2 años de edad. En niños de menos de 5 años de edad, los anticuerpos frente a los grupos A y C disminuyen sustancialmente a los 3 años después de la vacunación. Además, múltiples dosis de una vacuna con polisacáridos capsulares puede originar una hiporrespuesta.
En la actualidad esta disponible además, la vacuna del serogrupo C de N. meningitidis conjugada con un transportador proteico que contiene varios epitopos de células T. La introducción de la vacunación sistemática en la población ha originado una disminución del 66% de los portadores faríngeos asintomáticos de meningococo C. Desde 2005 esta disponible en USA la vacuna conjugada tetravalente (Menactra ®), que incorporal los 4 serogrupos clásicos de la vacuna frente a polisacáridos de la cápsula: A, C, Y, W135.
Las tres recomendaciones actuales para vacunación con Menactra incluyen:
- Vacunación de rutina en preadolescentes (11-12 años).
- Antes de la entrada en la Universidad si no estaba previamente vacunado.
- Otras colectividades en el rango de edad de 11 a 55 años.
Se ha comprobado que los contactos domésticos de un caso índice de enfermedad invasiva tienen un riesgo aumentado de desarrollar infección sistémica y que este riesgo se mantiene elevado durante la primera semana postexposición, para disminuir luego rápidamente. La quimioprofilaxis antibiótica se ha mostrado eficaz en el control del riesgo de infección sistémica tras contacto con un caso de enfermedad diseminada, riesgo que va a depender de las características de la cepa, del ambiente y del huésped. Las recomendaciones actuales sobre control de la enfermedad meningocócica pueden consultarse en: National Electronic Telecommunications System for Surveillance CDC. Prevention and Control of Meningococcal Disease: Recommendations of the Advisory Committee on Immunization Practices (ACIP) . 2000. El antibiótico habitualmente utilizado en quimioprofilaxis frente a N. meningitidis es la rifampicina a dosis de 10 mg/Kg, dos dosis al día durante 2 días; sin embargo en gestantes o pacientes con enfermedad hepática la ceftriaxona puede ser de elección, dosis IM única de 250 mg o 125 mg en menores de 2 años. El ciprofloxacino es también recomendado por algunos autores, aunque sus indicaciones en pediatría son limitadas. Tras profilaxis la recolonización por N. meningitidis puede ocurrir.
A. Fraser, A. Gafter-Gvili, M. Paul, and L. Leibovici. Prophylactic use of antibiotics for prevention of meningococcal infections: systematic review and meta-analysis of randomised trials. Eur J Clin Microbiol.Infect.Dis. 24 (3):172-181, 2005, evalúan la efectividad del tratamiento quimioprofiláctico antibiótico en la erradicación de N. meningitidis de la nasofaringe. Penicilina, ciprofloxacino, rifampicina y minociclina son efectivos para erradicar N. meningitidis de nasofaringe hasta 1 semana después de recibir profilaxis; sin embargo, tras un periodo de 1-2 semanas, solo rifampicina y ciprofloxacino se mostraron efectivos para erradicar N. meningitidis de nasofaringe. Tras 4 semanas sólo la rifampicina se mostró eficaz. Ningún estudio comparó ceftriaxona con placebo; sin embargo en las comparaciones entre rifampicina y ceftriaxona o ceftriaxona y ciprofloxacino, la ceftriaxona se mostró mas efectiva tras 1-2 semanas para erradicar N. meningitidis de la nasofaringe.
Dr. José Uberos Fernández
Hospital Clínico San Cecilio, Granada

